Quelle est la différence entre une synthase et une synthétase (faits révélés) - Toutes les différences
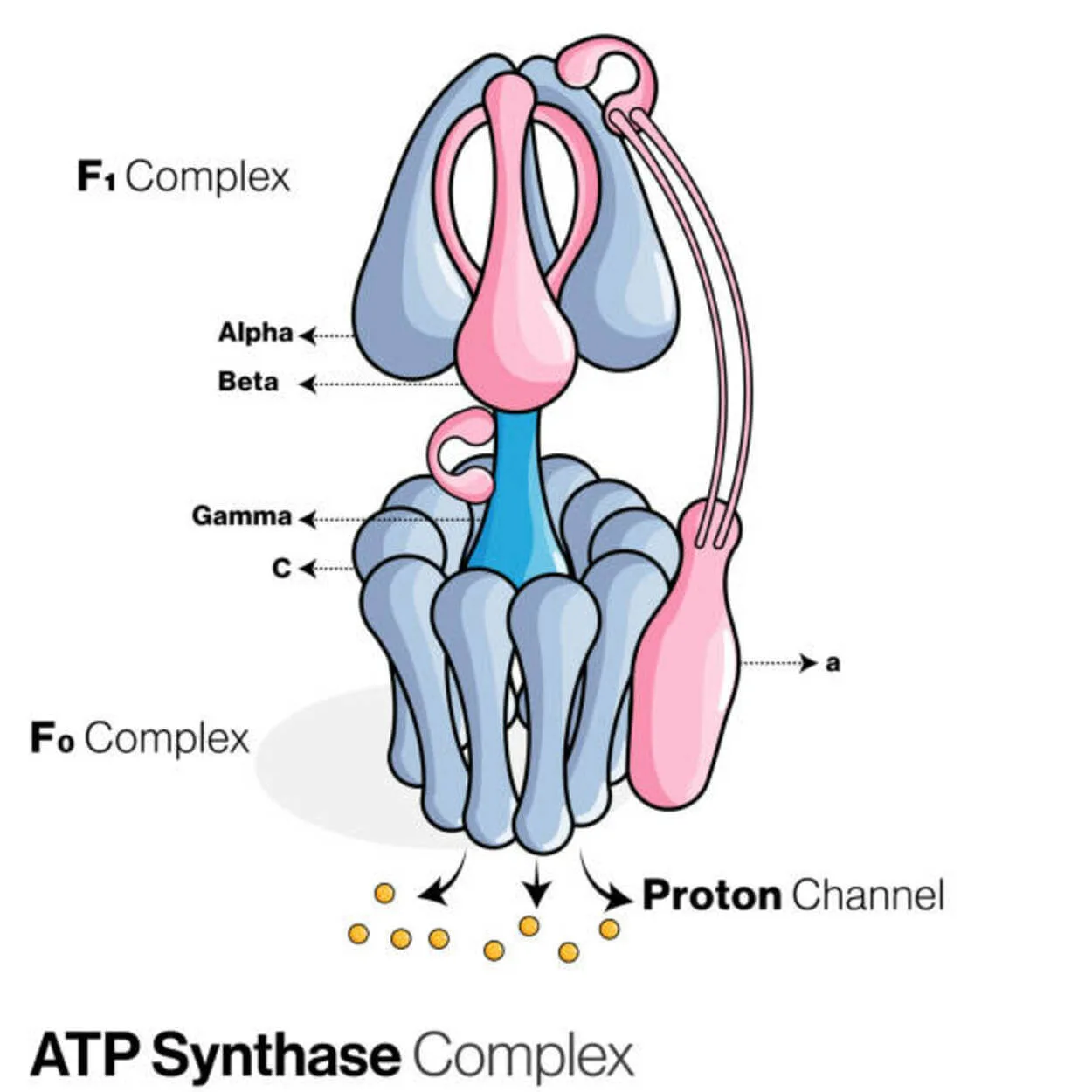
Table des matières
La classe E.C. 6 des enzymes ligases comprend les synthases et les synthétases. Elles participent aux réactions de synthèse et catalysent la combinaison de deux molécules tout en rompant simultanément la liaison diphosphate de l'ATP ou d'un autre triphosphate comparable.
Contrairement aux synthétases, qui utilisent l'ATP comme source d'énergie lors de la synthèse de composés biologiques, les synthases sont des ligases qui catalysent la synthèse de composés biologiques sans utiliser l'ATP comme source d'énergie.
Dans cet article, vous apprendrez à connaître exactement la différence entre la synthase et la synthétase.
Qu'est-ce que la synthase ?
Une synthase est une enzyme qui catalyse le processus de synthèse en biochimie. Rappelons que la nomenclature biologique distinguait initialement les synthétases et les synthases.
Conformément à la définition originale, les synthétases utilisent les nucléosides triphosphates (tels que l'ATP, le GTP, le CTP, le TTP et l'UTP) comme source d'énergie, ce qui n'est pas le cas des synthases.
Néanmoins, selon la Joint Commission on Biochemical Nomenclature (JCBN), le terme "synthase" peut être utilisé pour désigner toute enzyme qui catalyse la synthèse (qu'elle utilise ou non des nucléosides triphosphates), mais le terme "synthétase" ne devrait être utilisé que pour désigner la "ligase".
Voici une liste d'exemples de différents types de synthases :
- ATP synthase
- Citrate synthase
- Tryptophane synthase
- Pseudouridine synthase
- Acide gras synthase
- Cellulose synthase (formant l'UDP)
- Cellulose synthase (formant le PIB)
ATP Synthase
L'adénosine diphosphate (ADP) et le phosphate inorganique sont utilisés pour créer la molécule de stockage d'énergie adénosine triphosphate (ATP) par une protéine appelée ATP synthase (Pi).
Elle est classée comme ligase car elle modifie l'ADP en formant une liaison P-O (liaison phosphodiester). Un dispositif moléculaire appelé ATP synthase.
D'un point de vue énergétique, la production d'ATP à partir d'ADP et de Pi n'est pas souhaitable, et le processus se déroule généralement dans l'autre sens.
Un gradient de concentration de protons (H+) à travers la membrane mitochondriale interne chez les eucaryotes ou la membrane plasmique chez les bactéries fait avancer cette réaction en couplant la synthèse de l'ATP pendant la respiration cellulaire au gradient.
Chez les plantes, l'ATP synthase utilise un gradient de protons formé dans le lumen du thylakoïde pour traverser la membrane du thylakoïde et pénétrer dans le stroma du chloroplaste afin de produire de l'ATP au cours de la photosynthèse.
Pour une ATPase, les ATP synthases eucaryotes sont des F-ATPases qui fonctionnent "en sens inverse". Ce type est principalement abordé dans cet article. Les sous-unités FO et F1 d'une F-ATPase ont un mécanisme de moteur rotatif qui permet la synthèse de l'ATP.

Il existe différents types de synthases
Citrate Synthase
Presque toutes les cellules vivantes contiennent l'enzyme citrate synthase, qui sert de pacemaker dans la première étape du cycle de l'acide citrique et est désignée E.C. 2.3.3.1 (précédemment 4.1.3.7) (ou cycle de Krebs).
La citrate synthase est située dans la matrice mitochondriale des cellules eucaryotes, bien que ce soit l'ADN nucléaire, et non l'ADN mitochondrial, qui la code.
Il est créé dans le cytoplasme par les ribosomes cytoplasmiques, puis transféré dans la matrice mitochondriale.
La citrate synthase est un marqueur enzymatique quantitatif typique de l'existence de mitochondries intactes. Le pic d'activité de la citrate synthase révèle le nombre de mitochondries présentes dans le muscle squelettique.
L'entraînement par intervalles de haute intensité a le potentiel d'augmenter l'activité maximale davantage que l'entraînement d'endurance ou l'entraînement par intervalles de haute intensité.
L'acétyl coenzyme A a un résidu acétate à deux carbones et une molécule d'oxaloacétate à quatre carbones se condense pour générer un citrate à six carbones, qui est produit par la réaction de condensation catalysée par la citrate synthase.
Tryptophane Synthase
Les deux dernières étapes de la production de tryptophane sont catalysées par l'enzyme tryptophane synthase, également connue sous le nom de tryptophane synthétase.
Les Eubactéries, les Archaebactéries, les Protistes, les Champignons et les Plantes en sont des hôtes fréquents. En revanche, les Animalia n'en possèdent pas. Il se présente généralement sous la forme d'un tétramère 2 2.
Les sous-unités catalysent la conversion réversible du phosphate d'indole-3-glycérol en indole et en glycéraldéhyde-3-phosphate (G3P) (IGP).
Dans un processus dépendant du phosphate de pyridoxal (PLP), les sous-unités catalysent la condensation irréversible de l'indole et de la sérine pour générer du tryptophane.
Un canal hydrophobe interne de 25 angströms de long, situé dans l'enzyme, relie chaque site actif au site actif adjacent.
Cela favorise la canalisation du substrat, un mécanisme par lequel l'indole produit sur les sites actifs se diffuse directement vers d'autres sites actifs. La tryptophane synthase contient des sites actifs couplés de manière allostérique.
On découvre fréquemment que les Eubactéries, les Archaebactéries, les Protistes, les Champignons et les Plantes comprennent la tryptophane synthase, dont l'homme et les autres animaux sont dépourvus.
Le tryptophane est l'un des neuf acides aminés nécessaires à l'homme et l'un des vingt acides aminés standard. Le tryptophane est donc essentiel à l'alimentation humaine.
On sait également que la tryptophane synthétase peut utiliser des analogues de l'indole, tels que les indoles fluorés ou méthylés, comme substrats pour produire des analogues équivalents du tryptophane.
Pseudouridine
La lettre grecque psi- est utilisée pour abréger la pseudouridine, un isomère du nucléoside uridine dans lequel l'uracile est relié à l'atome de carbone par une liaison carbone-carbone plutôt que par une liaison glycosidique azote-carbone (l'uracile est parfois appelé "pseudouracile" dans cet arrangement).
L'altération la plus fréquente de l'ARN cellulaire est la pseudouridine. L'ARN peut subir plus de 100 altérations chimiques uniques au cours de la transcription et de la synthèse.
Outre les quatre nucléotides conventionnels, ceux-ci peuvent potentiellement affecter l'expression de l'ARN au niveau post-transcriptionnel et ont un certain nombre de fonctions dans la cellule, notamment la traduction, la localisation et la stabilité de l'ARN.
L'un d'entre eux est la pseudouridine, un isomère C5-glycoside de l'uridine avec une liaison C-C entre le C1 du sucre ribose et le C5 de l'uracile à la place de la liaison typique C1-N1 présente dans l'uridine.
La liaison C-C lui confère une mobilité de rotation et une souplesse de conformation supplémentaires. En outre, la position N1 de la pseudouridine possède un donneur de liaison hydrogène supplémentaire.
La pseudouridine, également appelée 5-ribosyluracile, est un composant familier mais mystérieux des ARN structurels (ARN de transfert, ribosomal, petit ARN nucléaire (snRNA) et petit nucléolaire). Elle a récemment été découverte dans l'ARN codant également.
Elle a été la première à être détectée, est la plus répandue et se retrouve dans les trois domaines évolutifs de la vie. Dans l'ARNt de la levure, la pseudouridine représente environ 4 % des nucléotides.
Grâce à la formation de liaisons hydrogène supplémentaires avec l'eau, cette modification des bases est capable de stabiliser l'ARN et d'améliorer l'empilement des bases.
Le nombre de pseudouridines augmente avec la complexité de l'organisme : 11 pseudouridines dans l'ARNr d'Escherichia coli, 30 dans l'ARNr cytoplasmique de la levure, une altération dans l'ARNr 21S mitochondrial et environ 100 dans l'ARNr de l'homme.
Il a été démontré que la pseudouridine dans l'ARNr et l'ARNt affine et stabilise la structure régionale et contribue au maintien de leurs rôles dans le décodage de l'ARNm, l'assemblage des ribosomes, le traitement et la traduction.
Il a été démontré que la pseudouridine dans les snRNA améliore l'interface entre le pré-ARNm et l'ARN spliceosomal pour aider à réguler l'épissage.
Synthase des acides gras
Chez l'homme, le gène FASN code pour l'enzyme connue sous le nom de synthase des acides gras (FAS), une protéine multi-enzyme qui catalyse la synthèse des acides gras.
Il s'agit d'un système enzymatique complet, et non d'une seule enzyme, composé de deux polypeptides multifonctionnels identiques de 272 kDa qui transfèrent des substrats d'un domaine fonctionnel à l'autre.
Sa principale fonction est d'utiliser le NADPH pour catalyser la création de palmitate (C16:0, un acide gras saturé à longue chaîne) à partir d'acétyl- et de malonyl-CoA.
L'acétyl-CoA et le malonyl-CoA sont convertis en acides gras par une séquence de processus de condensation décarboxylative de Claisen.
Après chaque cycle d'élongation, une cétoréductase (KR), une déshydratase (DH) et une énoyl réductase agissent en séquence pour diminuer le groupe bêta-céto jusqu'à la chaîne de carbone complètement saturée (ER).
Lorsque la chaîne d'acides gras a atteint une longueur de 16 carbones, elle est libérée par l'action d'une thioestérase (TE), qui est liée de manière covalente au groupe prosthétique phosphopantethéine d'une protéine porteuse d'acyle (ACP) (acide palmitique).
Cellulose Synthase (formation d'UDP)
La principale enzyme responsable de la production de cellulose est la cellulose synthase (EC 2.4.1.12) sous sa forme UDP. Elle est généralement appelée UDP-glucose : (1→4) 4-D-glucosyltransférase d'Enzymologie pour le D-glucan.
Le GDP-glucose est utilisé par une enzyme apparentée appelée cellulose synthase (GDP-forming) (EC 2.4.1.29). Les bactéries et les plantes possèdent des membres de cette famille d'enzymes.
Voir également: La différence de taille de 7 pouces entre un homme et une femme est-elle vraiment importante ? - Toutes les différencesLes membres bactériens peuvent également être connus sous le nom de BcsA (cellulose synthase bactérienne) ou CelA, tandis que les membres végétaux sont généralement connus sous le nom de CesA (cellulose synthase) ou de CslA (cellulose synthase-like) (simplement "cellulose").
Le CesA a été acquis par les plantes lors de l'endosymbiose qui a donné naissance au chloroplaste. La famille 2 des glucosyltransférases comprend celle-ci (GT2).
La majeure partie de la biomasse sur Terre est produite par biosynthèse et hydrolyse par des enzymes appelées glycosyltransférases.
La superfamille CesA des plantes est connue pour contenir sept sous-familles, et la superfamille combinée plantes-algues en contient 10.
Le seul groupe animal qui possède cette enzyme est celui des urochordés, qui l'ont obtenue par transfert horizontal de gènes il y a plus de 530 millions d'années.
Cellulose Synthase (formant le PIB)
Cette enzyme fait partie de la sous-famille des glycosyltransférases hexosyltransférases. Cette classe d'enzymes est désignée par son nom scientifique, GDP-glucose:1,4-beta-D-glucan 4-beta-D-glucosyltransférase.
D'autres noms fréquemment utilisés sont cellulose synthase (formant de la guanosine diphosphate), cellulose synthétase et guanosine diphosphoglucose-1,4-bêta-glucane glucosyltransférase. Cette enzyme participe au métabolisme du saccharose et de l'amidon.
Qu'est-ce que la synthétase ?
Le terme "synthétase", parfois appelé "ligase", désigne une classe d'environ 50 enzymes qui catalysent des réactions chimiques de conservation de l'énergie et assurent la médiation entre les événements de décomposition consommateurs d'énergie et les processus de synthèse productifs.
En coupant une liaison phosphate énergétique, ils génèrent l'énergie nécessaire pour catalyser la combinaison de deux molécules (dans de nombreux cas, par la conversion simultanée de l'adénosine triphosphate [ATP] en adénosine diphosphate [ADP]).
Une ligase dite aminoacide-ARN est une ligase qui catalyse la création d'une liaison carbone-oxygène entre un ARN de transfert et un acide aminé.
Lorsque certaines enzymes, telles que les amides synthétases et les peptides synthétases, sont actives, des liaisons carbone-azote (C-N) sont produites.
La synthétase est également connue sous le nom de ligase.
Différence entre synthétase et synthase
Une synthétase est une enzyme qui peut catalyser l'union de deux grosses molécules en créant une nouvelle liaison chimique, généralement avec l'hydrolyse simultanée d'un petit groupe chimique pendant sur l'une des plus grosses molécules, ou elle peut catalyser la liaison de deux composés, comme l'union de C-O, C-S, C-N, etc.
Une ligase provoque généralement la réaction suivante :
Voir également: Big Boss vs. Venom Snake : Quelle est la différence ? (Révélée) - Toutes les différences- A-C + b = Ab + C
- A+D + B + C + D + E + F = Ab + cD
La ligase peut réparer les cassures simple brin qui se produisent dans l'ADN double brin au cours de la réplication et relier deux fragments d'acide nucléique complémentaires.
En revanche, une synthase est une enzyme qui catalyse le processus de synthèse en biochimie. Elles sont incluses dans la catégorie des lyases selon la catégorisation des numéros CE.
Nomenclature
Rappelons que la nomenclature biologique distinguait initialement les synthétases et les synthases. Conformément à la définition originale, les synthétases utilisent les nucléosides triphosphates (tels que l'ATP, le GTP, le CTP, le TTP et l'UTP) comme source d'énergie, ce qui n'est pas le cas des synthases.
Néanmoins, selon la Joint Commission on Biochemical Nomenclature (JCBN), le terme "synthase" peut être utilisé pour désigner toute enzyme qui catalyse la synthèse (qu'elle utilise ou non des nucléosides triphosphates), mais le terme "synthétase" ne devrait être utilisé que pour désigner la "ligase".
La principale distinction entre la synthase et la synthétase est que la synthétase est une famille d'enzymes qui peuvent générer des liens entre les molécules, alors que la synthase est une enzyme.
| Synthase | Synthétase |
| Catalyse un processus de synthèse sans ATP | Nécessite de l'ATP |
| Relève de la classification des vases ou des transférases | Relève de la classification des ligases |
| par exemple HMG-COA synthase, ATP synthase | par exemple, Succiny1-COA synthetase, Glutamine synthétase |
Tableau comparatif Synthase vs Synthétase
Regardez cette vidéo pour en savoir plus sur la synthase et la synthétase
Conclusion
- Les synthétases n'ont pas besoin de NTP pour fonctionner puisqu'elles catalysent des processus de synthèse qui nécessitent l'hydrolyse de nucléosides triphosphates (et non simplement d'ATP).
- Le comité de nomenclature de l'Union internationale de biochimie a modifié la définition de la synthase dans les années 1980 pour englober toutes les enzymes synthétiques, qu'elles utilisent ou non des NTP, et synthétase est devenu synonyme de ligase.
- La ligase est une enzyme qui relie deux molécules plus petites en utilisant l'énergie de l'hydrolyse du NTP (généralement par une réaction de condensation).

