Qual è la differenza tra una sintasi e una sintetasi? (Fatti rivelati) - Tutte le differenze
Sommario
La classe E.C. 6 degli enzimi ligasi comprende le sintasi e le sintetasi, che partecipano alle reazioni di sintesi e catalizzano la combinazione di due molecole rompendo contemporaneamente il legame difosfato nell'ATP o in un altro trifosfato comparabile.
A differenza delle sintetasi, che utilizzano l'ATP come fonte di energia durante la sintesi di composti biologici, le sintetasi sono ligasi che catalizzano la sintesi di composti biologici senza utilizzare l'ATP come fonte di energia.
In questo articolo scoprirete la differenza tra sintasi e sintetasi.
Che cos'è la sintasi?
Una sintasi è un enzima che catalizza il processo di sintesi in biochimica. Si tenga presente che la nomenclatura biologica inizialmente distingueva tra sintetasi e sintasi.
Secondo la definizione originale, le sintetasi utilizzano i nucleosidi trifosfati (come ATP, GTP, CTP, TTP e UTP) come fonte di energia, mentre le sintetasi non lo fanno.
Tuttavia, secondo la Joint Commission on Biochemical Nomenclature (JCBN), il termine "sintasi" può essere utilizzato per indicare qualsiasi enzima che catalizza la sintesi (indipendentemente dal fatto che impieghi o meno i trifosfati nucleosidici), mentre il termine "sintetasi" dovrebbe essere utilizzato solo per indicare la "ligasi".
Ecco un elenco di esempi di diversi tipi di sintasi:
- ATP sintasi
- Citrato sintasi
- Triptofano sintasi
- Pseudouridina sintasi
- Acido grasso sintasi
- Cellulosa sintasi (UDP-formante)
- Cellulosa sintasi (formazione di GDP)
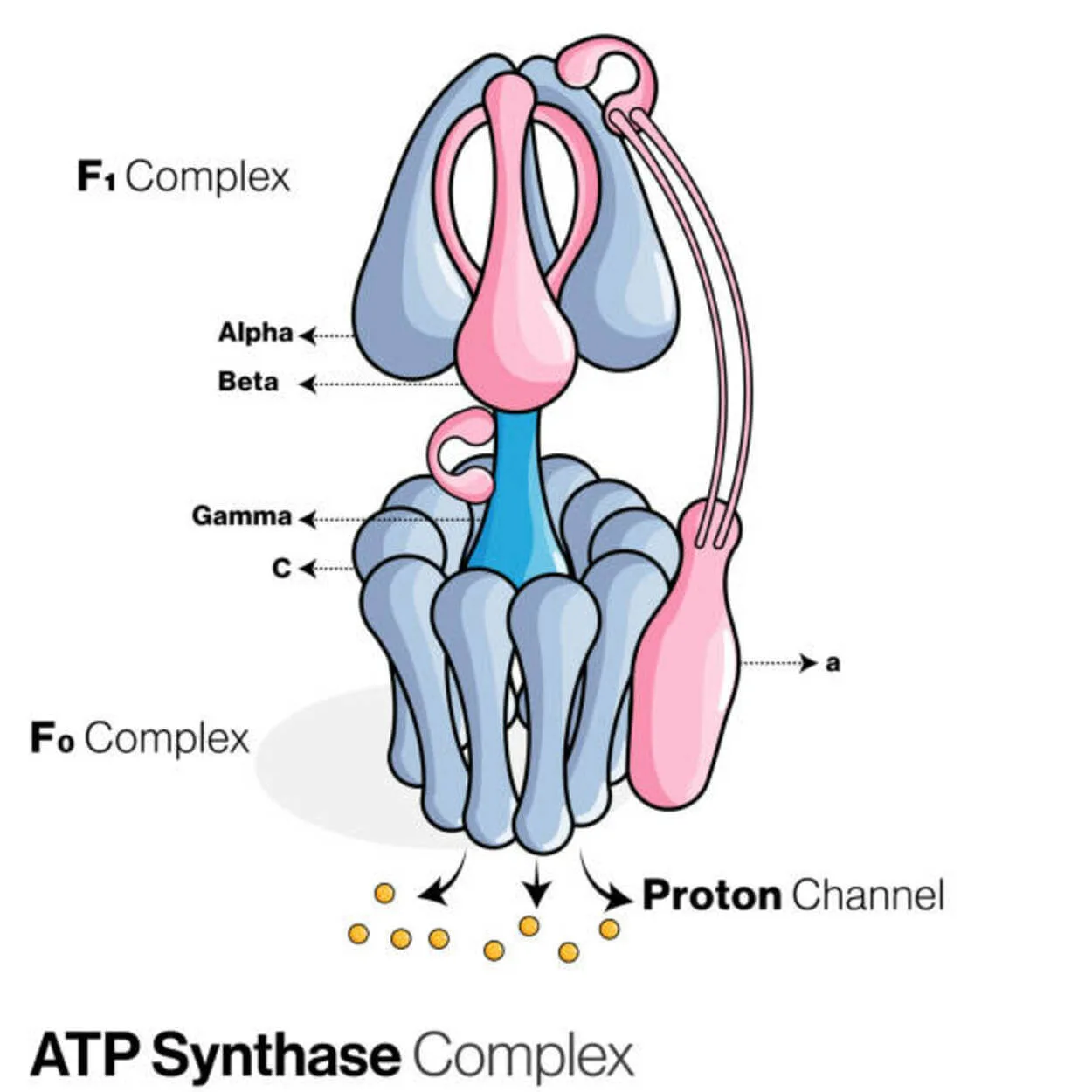
ATP sintasi
L'adenosina difosfato (ADP) e il fosfato inorganico sono utilizzati per creare la molecola di accumulo energetico adenosina trifosfato (ATP) da una proteina chiamata ATP sintasi (Pi).
È classificata come ligasi poiché modifica l'ADP formando un legame P-O (legame fosfodiestere). Un dispositivo molecolare chiamato ATP sintasi.
Dal punto di vista energetico, la produzione di ATP a partire da ADP e Pi è indesiderabile e il processo si svolge tipicamente in senso inverso.
Un gradiente di concentrazione di protoni (H+) attraverso la membrana mitocondriale interna negli eucarioti o la membrana plasmatica nei batteri fa avanzare questa reazione accoppiando al gradiente la sintesi di ATP durante la respirazione cellulare.
Nelle piante, l'ATP sintasi utilizza un gradiente protonico formatosi nel lume del tilo attraverso la membrana tiloidea e nello stroma del cloroplasto per produrre ATP durante la fotosintesi.
Per quanto riguarda le ATPasi, le ATP sintasi eucariotiche sono F-ATPasi che funzionano "al contrario". Questo tipo viene discusso principalmente in questo articolo. Le subunità FO e F1 di una F-ATPasi hanno un meccanismo di motore rotazionale che consente la sintesi di ATP.

Esistono diversi tipi di sintasi
Citrato sintasi
Quasi tutte le cellule viventi contengono l'enzima citrato sintasi, che funge da pacemaker nella prima fase del ciclo dell'acido citrico ed è denominato C.E. 2.3.3.1 (precedentemente 4.1.3.7) (o ciclo di Krebs).
La citrato sintasi si trova nella matrice mitocondriale delle cellule eucariotiche, anche se il DNA nucleare, non quello mitocondriale, la codifica.
Viene creato nel citoplasma dai ribosomi citoplasmatici e successivamente trasferito nella matrice mitocondriale.
Un tipico marcatore enzimatico quantitativo dell'esistenza di mitocondri intatti è la citrato sintasi, il cui picco di attività rivela quanti mitocondri sono presenti nel muscolo scheletrico.
L'allenamento a intervalli ad alta intensità ha il potenziale di aumentare l'attività massima più dell'allenamento di resistenza o dell'allenamento a intervalli ad alta intensità.
L'acetil coenzima A ha un residuo di acetato a due atomi di carbonio e una molecola di ossalacetato a quattro atomi di carbonio si condensa per generare citrato a sei atomi di carbonio, prodotto dalla reazione di condensazione catalizzata dalla citrato sintasi.
Triptofano sintasi
Le due fasi finali della produzione di triptofano sono catalizzate dall'enzima triptofano sintasi, noto anche come triptofano sintetasi.
Eubacteria, Archaebacteria, Protista, Fungi e Plantae ne sono ospiti frequenti. Tuttavia, Animalia non lo possiede. Di solito, si presenta come un 2 2 tetramero.
Le subunità catalizzano la conversione reversibile dell'indolo-3-glicerolo fosfato in indolo e gliceraldeide-3-fosfato (G3P) (IGP).
In un processo dipendente dal piridossal fosfato (PLP), le subunità catalizzano la condensazione irreversibile di indolo e serina per generare triptofano.
Un canale idrofobico interno, lungo 25 angstrom e situato nell'enzima, collega ciascun sito attivo al sito attivo adiacente.
Questo favorisce la canalizzazione del substrato, un meccanismo per cui l'indolo prodotto nei siti attivi diffonde direttamente ad altri siti attivi. La triptofano sintasi contiene siti attivi accoppiati allostericamente.
Si scopre spesso che Eubacteria, Archaebacteria, Protista, Fungi e Plantae contengono triptofano sintasi, mentre l'uomo e gli altri animali ne sono privi.
Il triptofano è uno dei nove aminoacidi necessari all'uomo e uno dei venti aminoacidi standard. Il triptofano è quindi essenziale per la dieta umana.
È anche noto che la triptofano sintetasi può utilizzare analoghi dell'indolo, come indoli fluorurati o metilati, come substrati per produrre analoghi del triptofano equivalenti.
Pseudouridina
La lettera greca psi- è usata per abbreviare la pseudouridina, un isomero del nucleoside uridina in cui l'uracile è unito all'atomo di carbonio da un legame carbonio-carbonio piuttosto che da un legame glicosidico azoto-carbonio (l'uracile è occasionalmente indicato come "pseudouracile" in questa disposizione).
L'alterazione più diffusa nell'RNA cellulare è la pseudouridina. L'RNA può subire oltre 100 alterazioni chimiche uniche durante la trascrizione e la sintesi.
Oltre ai quattro nucleotidi convenzionali, questi potrebbero potenzialmente influenzare l'espressione dell'RNA a livello post-trascrizionale e avere una serie di funzioni nella cellula, tra cui la traduzione, la localizzazione e la stabilità dell'RNA.
Uno di questi è la pseudouridina, un isomero C5-glicoside dell'uridina con un legame C-C tra il C1 dello zucchero ribosio e il C5 dell'uracile al posto del tipico legame C1-N1 presente nell'uridina.
Grazie al legame C-C, possiede una mobilità rotazionale e una flessibilità conformazionale supplementari. Inoltre, la posizione N1 della pseudouridina possiede un ulteriore donatore di legami idrogeno.
La pseudouridina, chiamata anche 5-ribosiluracile, è un componente familiare ma misterioso degli RNA strutturali (transfer, ribosomiali, piccoli nucleari (snRNA) e piccoli nucleolari). Recentemente è stata trovata anche negli RNA codificanti.
È stata la prima ad essere individuata, è la più diffusa e si trova in tutti e tre i domini evolutivi della vita. Nel tRNA del lievito, la pseudouridina costituisce circa il 4% dei nucleotidi
Grazie alla formazione di ulteriori legami idrogeno con l'acqua, questa alterazione della base è in grado di stabilizzare l'RNA e di migliorare il base-stacking.
Il numero di pseudouridine cresce con la complessità di un organismo: ci sono 11 pseudouridine nell'rRNA dell'Escherichia coli, 30 nell'rRNA citoplasmatico del lievito, un'alterazione nell'rRNA mitocondriale 21S e circa 100 nell'rRNA dell'uomo.
Guarda anche: Leggings VS pantaloni da yoga VS collant: differenze - Tutte le differenzeÈ stato dimostrato che la pseudouridina nell'rRNA e nel tRNA mette a punto e stabilizza la struttura regionale e contribuisce al mantenimento dei loro ruoli nella decodifica dell'mRNA, nell'assemblaggio del ribosoma, nell'elaborazione e nella traduzione.
È stato dimostrato che la pseudouridina negli snRNA migliora l'interfaccia tra il pre-mRNA e l'RNA spliceosomiale, contribuendo a regolare lo splicing.
Acido grasso sintasi
Il gene FASN nell'uomo codifica l'enzima noto come sintasi degli acidi grassi (FAS), una proteina multienzimatica chiamata sintasi degli acidi grassi che catalizza la sintesi degli acidi grassi.
Si tratta di un intero sistema enzimatico, non di un solo enzima, costituito da due polipeptidi multifunzionali identici di 272 kDa che trasferiscono i substrati da un dominio funzionale all'altro.
Il suo compito principale è quello di utilizzare il NADPH per catalizzare la creazione di palmitato (C16:0, un acido grasso saturo a lunga catena) a partire da acetil- e malonil-CoA.
L'acetil-CoA e il malonil-CoA vengono convertiti in acidi grassi attraverso una sequenza di processi decarbossilativi di condensazione di Claisen.
Dopo ogni ciclo di allungamento, una chetoreduttasi (KR), una disidratasi (DH) e una enoilreduttasi lavorano in sequenza per ridurre il gruppo beta cheto alla catena carboniosa completamente satura (ER).
Quando la catena di acidi grassi ha raggiunto una lunghezza di 16 carboni, viene rilasciata dall'azione di una tioesterasi (TE), che è connessa covalentemente al gruppo prostetico fosfopantetina di una proteina portatrice di acili (ACP) (acido palmitico).
Cellulosa sintasi (formazione di UDP)
L'enzima principale responsabile della produzione di cellulosa è la cellulosa sintasi (EC 2.4.1.12) nella sua forma UDP-formante, generalmente indicata come UDP-glucosio: (1→4) 4-D-glucosiltransferasi di Enzymology per il D-glucano.
Il GDP-glucosio viene utilizzato da un enzima correlato chiamato cellulosa sintasi (GDP-forming) (EC 2.4.1.29). Sia i batteri che le piante hanno membri di questa famiglia di enzimi.
I membri batterici possono essere conosciuti anche come BcsA (cellulosa sintasi batterica) o CelA, mentre i membri vegetali sono tipicamente conosciuti come CesA (cellulosa sintasi) o la speculare CslA (cellulosa sintasi-like) (semplicemente "cellulosa").
La CesA è stata acquisita dalle piante in seguito all'endosimbiosi che ha dato origine al cloroplasto. La famiglia 2 delle glucosiltransferasi comprende questa (GT2).
La maggior parte della biomassa sulla Terra è prodotta attraverso la biosintesi e l'idrolisi da parte di enzimi chiamati glicosiltransferasi.
La superfamiglia CesA delle piante è nota per contenere sette sottofamiglie e la superfamiglia combinata piante-alghe ne contiene dieci.
Guarda anche: Quali sono le differenze tra Budget e Avis? - Tutte le differenzeL'unico gruppo animale che possiede questo enzima è quello degli urocordati, che l'hanno ottenuto tramite trasferimento genico orizzontale più di 530 milioni di anni fa.
Cellulosa sintasi (formazione di GDP)
Questo enzima è un membro della sottofamiglia delle glicosiltransferasi esosiltransferasi. Questa classe di enzimi è indicata con il suo nome scientifico, GDP-glucosio:1,4-beta-D-glucano 4-beta-D-glucosiltransferasi.
Altri nomi frequentemente utilizzati sono cellulosa sintasi (che forma guanosina difosfato), cellulosa sintetasi e guanosina difosfoglucosio-1,4-beta-glucano glucosiltransferasi. Questo enzima interviene nel metabolismo del saccarosio e dell'amido.
Che cos'è la sintetasi?
Il termine "sintetasi", talvolta noto come "ligasi", si riferisce a una classe di circa 50 enzimi che catalizzano reazioni chimiche a risparmio energetico e mediano tra eventi di degradazione che consumano energia e processi di sintesi produttivi.
Scindendo un legame fosfato energetico, generano l'energia necessaria per catalizzare la combinazione di due molecole (in molti casi, attraverso la conversione simultanea di adenosina trifosfato [ATP] in adenosina difosfato [ADP]).
Una ligasi nota come aminoacido-RNA ligasi è quella che catalizza la creazione di un legame carbonio-ossigeno tra un RNA transfer e un aminoacido.
Quando alcuni enzimi, come le sintetasi amidiche e le sintetasi peptidiche, sono attivi, vengono prodotti legami carbonio-azoto (C-N).
La sintetasi è nota anche come ligasi
Differenza tra sintetasi e sintetasi
Una sintetasi è un enzima che può catalizzare l'unione di due grandi molecole creando un nuovo legame chimico, in genere con l'idrolisi simultanea di un piccolo gruppo chimico pendente su una delle molecole più grandi, oppure può catalizzare il collegamento di due composti, come l'unione di C-O, C-S, C-N, ecc.
Una ligasi in genere provoca la seguente reazione:
- A-C + b = Ab + C
- A+D + B + C + D + E + F = Ab + cD
La ligasi può riparare le rotture a singolo filamento che si sviluppano nel DNA a doppio filamento durante la replicazione e collegare due frammenti di acido nucleico complementari.
D'altra parte, la sintasi è un enzima che catalizza il processo di sintesi in biochimica. Sono inclusi nella categoria delle liasi secondo la categorizzazione del numero EC.
Nomenclatura
Si tenga presente che la nomenclatura biologica inizialmente distingueva tra sintetasi e sintetasi: secondo la definizione originale, le sintetasi utilizzano i trifosfati nucleosidici (come ATP, GTP, CTP, TTP e UTP) come fonte di energia, mentre le sintetasi non lo fanno.
Tuttavia, secondo la Joint Commission on Biochemical Nomenclature (JCBN), il termine "sintasi" può essere utilizzato per indicare qualsiasi enzima che catalizza la sintesi (indipendentemente dal fatto che impieghi o meno i trifosfati nucleosidici), mentre il termine "sintetasi" dovrebbe essere utilizzato solo per indicare la "ligasi".
La distinzione principale tra sintasi e sintetasi è che la sintetasi è una famiglia di enzimi che possono generare legami tra le molecole, mentre la sintetasi è un enzima.
| Sintasi | Sintetasi |
| Catalizza un processo di sintesi senza ATP | Richiede ATP |
| Rientra nella classificazione di vaso o transfert | Rientra nella classificazione delle ligasi |
| Ad esempio, l'HMG-COA sintasi, l'ATP sintasi. | Ad esempio Succinina1-COA sintetasi, Glutammina sintetasi |
Tabella di confronto Sintasi vs Sintetasi
Guardate questo video per conoscere la sintasi e la sintetasi
Conclusione
- Le sintetasi non hanno bisogno di NTP per funzionare, poiché catalizzavano processi di sintesi che richiedevano l'idrolisi di nucleosidi trifosfati (non semplicemente ATP).
- Negli anni '80 il Comitato di Nomenclatura dell'Unione Internazionale di Biochimica ha modificato la definizione di sintasi per includere tutti gli enzimi di sintesi, che utilizzassero o meno gli NTP, e la sintetasi è diventata sinonimo di ligasi.
- La ligasi è un enzima che unisce due molecole più piccole utilizzando l'energia dell'idrolisi dell'NTP (di solito attraverso una reazione di condensazione).

